01. Um gás
ideal sofre a transformação A → B → C indicada no diagrama.
O trabalho realizado
pelo gás nessa transformação, em joules, vale:
a) 2,0.106 b) 1,5.106 c) 1,5.106 d) 1,2.106 e) 1,2.106
WABC
= WAB + WBC = (5 – 2).5.105 + 0 = 15.105
= 1,5.106 J.
02.
a) 4 J b) 16 J c)
24 J d) 380 J e) 420 J
I. W = P.ΔV = 4.(2 – 1) = 4 J.
II. ΔU = Q – W = 20 – 4 = 16 J.
03. Uma certa quantidade de
gás ideal realiza o ciclo ABCDA, representado na figura:
I. W = b.h = (1,2
– 0,2).(4 – 2).102 = 1.2.102 = 200 J. (sentido horário o trabalho é positivo)
II. ΔU = Q – W, num ciclo ΔU = 0, logo Q = W = 200 J.
04. Admita
uma máquina térmica, funcionando em ciclo de Carnot, sendo de 300 k a
temperatura da fonte fria. Se o rendimento dessa máquina é 20%, a temperatura
da fonte quente é:
a)
320 k b) 360 k c) 375 k
d) 395 k
η = 1 – T2/T1
→ 0,2 = 1 – 300/T1 → 300/T1 = 0,8 → T1 = 300/0,8 = 375 k.
05. Nas
transformações isotérmicas dos gases perfeitos, é incorreto afirmar:
a)
não há variação de temperatura.
b)
a variação da energia interna do gás é nula.
c) não ocorre troca de calor entre o gás e o ambiente.
d) o calor trocado pelo gás com o exterior é
igual ao trabalho realizado no mesmo processo.
ΔU = O numa transformação isotérmica, logo Q = W.
06. O
tipo de transformação em que é nulo o trabalho efetuado pelo ambiente sobre o
gás é:
a) adiabática
b) isobárica c)
isotérmica d)
isométrica
07. Uma
garrafa hermeticamente fechada contém 1 litro de ar. Ao ser colocada na geladeira,
onde a temperatura é de 3°C, o ar interno cedeu 10 calorias até entrar em
equilíbrio com o interior da geladeira. Desprezando-se a variação de volume da
garrafa, a variação da energia interna desse gás foi:
a) - 13 cal
b) 13 cal c) - 10 cal
d) 10 cal
ΔU = Q – W = – 10 – 0 = – 10 cal.
08. Através de uma transformação
termodinâmica, uma massa gasosa absorve uma quantidade de calor ΔQ e realiza um trabalho ΔW , sofrendo uma mudança ΔU em sua energia interna. Assinale a alternativa
correta.
a) ΔQ = 0 se a transformação for isotérmica.
b) ΔU = 0 se a transformação for adiabática.
c) ΔU = ΔQ se a
transformação for isovolumétrica.
d) ΔW = 0 se a transformação for isobárica.
09. Puxa-se
lentamente o êmbolo de uma seringa de injeção, que contém ar aprisionado, da
marca 1,0 cm3 até a marca de 1,5 cm3. Neste processo a
pressão variou de 1,0 N/m2 para 0,50 N/m2, a uma
temperatura constante. Sendo de 1,0 cm2 a área da seção transversal
do êmbolo da seringa e supondo que se tenha aplicado uma força constante de
intensidade 3,0 N, a quantidade de calor trocada exclusivamente neste processo
termodinâmico, em joules, é:
a) 1,5x10-2 b) 2,0x10-2 c) 2,5x10-2 d) 3,0x10-2
I. ΔV = A.d
0,5 = 1.d
d = 0,5 cm = 5.10-3 m.
II. W = F.d = 3.5.10-3 = 1,5x10-2
J.
10. Ao se encher o pneu de
uma bicicleta com uma bomba, percebe-se que a temperatura dele aumenta. Tal
fenômeno acontece fundamentalmente porque:
a) ao ser injetado no pneu, o ar
conduz calor até o seu interior, elevando sua temperatura.
b) ao ser injetado no pneu, sob
pressão, o ar no seu interior sofre uma reação química exotérmica,
aquecendo-se.
c) ao receber o ar em movimento,
forças de atrito têm de atuar, para trazê-lo até o repouso em relação ao pneu,
provocando aquecimento do ar.
d) ao ser comprimido para
dentro do pneu, realiza-se trabalho sobre o ar, aumentando sua energia interna
e, por conseguinte, sua temperatura.
11. A figura mostra três etapas de um
processo termodinâmico isotérmico à temperatura T, no qual ∆V1 = ∆V2
= ∆V3. Considere que ∆W e ∆U são o trabalho realizado pelo sistema e
a variação de energia interna em cada etapa, respectivamente.
Observando as três etapas,
pode-se afirmar corretamente que
a) ∆W1 < ∆W2
e ∆U1 > ∆U2 .
b) ∆W2 >
∆W3 e ∆U2 = ∆U3 .
c) ∆W2 < ∆W3
e ∆U2 > ∆U3 .
d) ∆W3 > ∆W2
e ∆U1 = ∆U2 .
∆U1 = ∆U2
= ∆U3 = 0
(isotérmico). Porém, ∆V1 = ∆V2
= ∆V3
A1
A2
A3 ,
12. Um mol de
um gás ideal sofre uma expansão isobárica com um correspondente aumento de
temperatura ΔT. Seja R a constante universal dos gases.
Neste processo, o trabalho por mol realizado pelo gás é
a) (R/ΔT)2. b) RΔT. c) R/ΔT. d) (RΔT)2.
I.
P.V = N.R.ΔT e W = P.V.
II.
W = 1.R.ΔT = R.ΔT.
13. Um sistema formado por uma dada massa gasosa sofre uma
transformação, absorvendo uma quantidade de calor Q, realizando um trabalho T e
sofrendo uma variação ∆U em sua energia interna. Analise as características de
cada uma das transformações que passa este sistema e julgue
as seguintes proposições, escrevendo V ou F conforme sejam verdadeiras ou
falsas, respectivamente.
( ) ∆U = O se a transformação for adiabática.
( ) T = Q se a transformação for isotérmica.
( ) Q > T se a transformação for uma expansão
isobárica.
( ) ∆U = Q se a transformação for isovolumétrica.
( ) Q = 0 se a transformação for isotérmica.
Assinale a alternativa que apresenta a seqüência correta.
a) VFFVF b)
VFVFV c) VVFVF d) FVVVF e) VVVFV
∆U = 0 se a transformação
for isotérmica e Q = 0 se for adiabática
14. Em uma transformação isotérmica, um gás ideal realiza um
trabalho de 200 J. Calcule.
a) A variação da energia interna do gás.
Como a energia interna de um gás ideal só
depende da temperatura, e esta não varia, então a variação da energia interna ∆U
é igual a zero.
b) A energia recebida pelo gás na forma de calor.
Usando a primeira lei da termodinâmica:
∆U=Q - W => 0 = Q –
W => Q = W= 200 J.
15. Numa
transformação são fornecidas 200 calorias a um sistema sobre o qual se realiza,
ao mesmo tempo, um trabalho de 100 joules. Admitindo-se que 1 cal = 4,2 J,
pode-se afirmar que o aumento da energia interna desse sistema, em joules, é
igual a:
a)
220 b) 620 c) 940 d) 840 e) 740
ΔU = Q – W = 200.4,2 + 100
= 840 + 100 = 940 J
16. De
acordo com a primeira lei da termodinâmica, se um sistema recebe 200 joules de
calor e realiza 200 joules de trabalho, a variação de sua energia interna é, em
joules, de:
a)
-400 b) -200 c) zero d) 200 e) 400
ΔU = Q – W = 200 – 200 = 0
17. Perfumes, desodorantes, inseticidas e muitos outros produtos
podem ser encontrados na forma de aerossóis. No instante em que pressionamos a válvula reguladora do frasco que contém um
desses produtos, o gás se expande rapidamente.
Então, pela Primeira Lei da
Termodinâmica, conclui-se que a transformação descrita no texto é
a) não é adiabática e, portanto, há troca de energia com
o meio exterior.
b) adiabática e, portanto, não há troca de
energia térmica ou calor com o meio exterior.
c) isobárica, e a energia interna do gás permanece constante.
d) isocórica, e a variação da energia interna do gás aumenta.
e) isotérmica, e não há variação da energia
interna.
18. Um gás ideal sofre uma transformação termodinâmica em que
cede 200 J de calor ao ambiente. Na mesma transformação, o gás realiza 200 J de
trabalho. Pode-se afirmar que a variação de energia interna do gás em tal transformação
é igual a:
A) −400 J B) −200 J
C) 0 D) 200 J E) 400 J
Pela 1ª lei da
Termodinâmica, ΔU = Q – W = – 200 – 200 = – 400 J.
19. Uma
máquina térmica executa o ciclo descrito no diagrama p-V abaixo. O ciclo
se inicia no estado A, vai para o B, seguindo a parte superior do
diagrama, e retorna para A, passando por C. Sabendo-se que poVo
= 13 J, calcule o trabalho realizado por esta máquina térmica ao longo de
um ciclo, em joules.
W = b.h/2 = (3po - po).(3vo - vo)/2 = 4.poVo / 2 = 2.poVo = 2.13 = 26 J.
20. Uma máquina térmica recebe uma determinada quantidade de
calor e realiza um trabalho útil de 400 J. Considerando que o trabalho da
máquina é obtido isobaricamente a uma pressão de 2,0 atm, num pistão que contém
gás, determine a variação de volume sofrida pelo gás dentro do pistão. Considere
1,0 atm = 1,0.105N/m2.
a) 2,0.10-3 b) 10-3 c) 8.10-3 d) 5.10-4
∆V = W/P = 400/2.105
= 2,0.10-3.
21. Uma máquina térmica realiza em cada segundo
quatro ciclos de Carnot. Em cada ciclo a máquina recebe 1000 J da fonte quente
e cede 600 J para a fonte fria. A potência e o rendimento da máquina,
respectivamente, são
a) 1000 W e 50% b) 1600 W e 40% c) 1200 W e 30% d) 1400 W e 50%
I. W = Q1 – Q2
= 1000 – 600 = 400 J.
II. η = W/Q1 =
400/1000 = 0,40 = 40 %.
III. P = W/Δt = 400/1 = 400
W, como são quatro ciclos temos P = 4.400 = 1600 W.
22. Uma máquina de
CARNOT, reversível, é projetada para operar entre duas fontes térmicas,
seguindo o ciclo representado a seguir.
O rendimento da referida máquina é
a) 10% b) 20% c)
25% d) 50% e) 80%
η = 1 – T2 / T1
= 1 – 400/500 = 1 – 0,8 = 0,2 = 20%
23. A cada ciclo, uma máquina térmica extrai 45 kJ de calor da sua fonte quente
e descarrega 36 kJ de calor na sua fonte fria. O rendimento máximo que essa
máquina pode ter é de
a) 20%. b) 25%. c) 75%. d) 80%. e) 100%
η = 1 – Q2 / Q1 = 1 – 36/45 = 1 – 0,8 = 0,2 = 20%
24. Um motor de Carnot
recebe da fonte quente 100 cal por ciclo e rejeita 80 cal para a fonte fria. Se
a temperatura da fonte quente é de 127 °C, qual a temperatura da fonte fria?
Q1/Q2 = T1/T2
=> 100/80 = 400/T2 => T2 = 80.4 = 320 k = 320 – 273
= 470C.
25. O rendimento de certa
máquina térmica de Carnot é de 40%, e a fonte fria é a própria atmosfera a 27 °C.
Qual a temperatura da fonte quente?
η = 1 – T2 / T1 => 1 - 0,4 = 300/ T1 => T1 = 300/0,6 = 500 K.
26. O esquema a seguir representa trocas de calor e
realização de trabalho em uma máquina térmica. Os valores de T1 e Q2 não
foram indicados, mas deverão ser calculados durante a solução desta questão.
Considerando-se
os dados indicados no esquema, se essa máquina operasse segundo um ciclo de
Carnot, a temperatura T1, da fonte quente, serial igual a:
a)
375 K b) 400 K c) 525 K d) 1.200 K e) 1.500 K
Q2 = Q1
– τ = 4 000 – 800 = 3 200 J.
Como: T1/T2
= Q1/Q2, então: T1/300 = 4 000/3 200
T1 = 375 K.
27. O rendimento real de um motor a gasolina está entre
20% e 25%. As perdas mecânicas e térmicas desse motor atingem de 75% a 80% da
energia liberada pelo combustível. As perdas térmicas, calor trocado com o
ambiente pelo sistema de refrigeração, atingem 30%. Outros 35% acompanham os
gases expelidos ainda a altas temperaturas e mais 10% são perdas mecânicas,
devido ao atrito das superfícies metálicas e à inércia do pistão. O rendimento
de uma máquina térmica é definido pela razão entre a energia mecânica obtida
(por meio do trabalho) e a energia total fornecida pela explosão do
combustível: η = W/Q.
Um dos procedimentos usados para elevar o rendimento
de um motor a explosão é aumentar a razão entre o volume máximo e o mínimo que
a mistura ocupa dentro do cilindro. Essa relação depende do combustível
utilizado. Nos motores a gasolina, o volume máximo é oito vezes maior que o mínimo,
isto é, a sua taxa de compressão é de 8:1; nos motores a álcool, essa taxa é de
12:1, e, nos motores a diesel, é de 18:1. Assim, quanto mais diminuímos
o volume mínimo, maior será a taxa de compressão e o rendimento. No entanto,
esse volume mínimo tem seu limite, pois o combustível pode explodir mesmo sem
faísca, quando muito comprimido. Por isso, acrescenta-se ao combustível um
antidetonante – que no caso da gasolina é o álcool anidro.
A alternativa correta, com base no texto anterior, é:
A) Em um motor a explosão, as maiores perdas são
mecânicas, devido ao atrito entre as superfícies metálicas.
B) Dos combustíveis citados, o álcool não precisa de
antidetonante, pois ele próprio é antidetonante.
C) O álcool anidro é misturado à gasolina para aumentar
o rendimento do motor.
D) Um motor a explosão pode ter um rendimento muito
próximo de 100%.
E) A maior taxa de compressão ocorre nos
motores a diesel (18:1). Assim, dos combustíveis citados, o diesel é
o que apresenta maior rendimento.
A maior taxa de compressão
ocorre nos motores a diesel (18:1), fazendo com que eles apresentem
maior rendimento.
28. A palavra ciclo tem vários significados na
linguagem cotidiana. Existem ciclos na economia, na literatura, na história e,
em geral, com significados amplos, pois se referem a tendências, épocas, etc.
Em termodinâmica, a palavra ciclo tem um significado preciso: é uma série de
transformações sucessivas que recolocam o sistema de volta ao seu estado
inicial com realização de trabalho positivo ou negativo e a troca de calor com
a vizinhança. Assim, por exemplo, os motores automotivos foram bem
compreendidos a partir das descrições de seus ciclos termodinâmicos. Considere
o quadro a seguir onde são apresentadas três máquinas térmicas operando em
ciclos entre fontes de calor nas temperaturas 300 k e 500 k. Q e W são,
respectivamente, o calor trocado e o trabalho realizado em cada ciclo.
Máquina
|
Q(Joule)
|
W(Joule)
|
A
|
10.000
|
10.000
|
B
|
12.000
|
6000
|
C
|
8000
|
3000
|
De acordo com a
termodinâmica, é possível construir:
A) as máquinas A, B e
C.
B) a máquina B
apenas.
C) a máquina C
apenas.
D) a máquina A apenas.
E) as máquinas A e B.
Cálculo do máximo
rendimento dessa máquina: η = 1 – 300/500 = 1,0 – 0,6 = 0,4 = 40%. Logo
nenhuma das máquinas pode ter rendimento superior a 0,4.
Para A: η
=10.000/10.000 = 1 (não pode, superior a 0,4)
Para B: η = 6.000/12.000
= 0,5 (não pode, superior a 0,4).
Para C: η =3.000/8.000 = 0,375 (pode,
inferior a 0,4).
29. Uma estudante do terceiro ano do
Ensino Médio reside numa casa situada a 900 m acima do nível do mar. Ela
está interessada em descobrir qual é a temperatura de ebulição da água,
fervendo em uma panela aberta, na cozinha de sua casa. Ela pesquisa e descobre
que a pressão atmosférica diminui 1 cmHg para cada 100 m de
elevação na atmosfera da Terra. Em seguida, consultando a tabela abaixo, que
relaciona a pressão atmosférica exercida sobre a água, p, com sua
temperatura de ebulição, T, conclui, de forma correta, que a
temperatura de ebulição procurada, em °C, é:
P (cmHg)
|
76
|
72
|
67
|
64
|
60
|
T (°C)
|
100
|
98
|
97
|
95
|
93
|
A) 98 B) 95 C) 100 D) 93 E) 97
De acordo com o texto, a pressão atmosférica diminui
de 1 cmHg para cada 100 m de elevação, então: P = 76 – 9 = 67 cmHg que
corresponde a 970 C. Obs.: 900/100 = 9 cmHg.
30. Considerando que a
máquina acima opera, aproximadamente, segundo um ciclo de Carnot conforme
ilustrado abaixo. Podemos concluir que:
A) Na etapa de a =>
B) Na etapa de b =>
C) Na etapa de c =>
D) Na etapa de d =>
E) Na etapa de a =>
Na etapa de a =>
Na etapa de b => c do ciclo o processo é
adiabático e o calor transferido pela máquina é nulo.
Na etapa de c =>
Na etapa de d =>
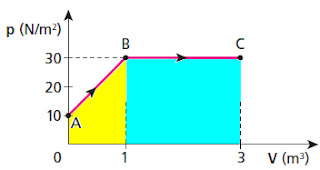
31. O gráfico pressão (p) volume (V) representa as transformações AB e BC experimentadas por um gás ideal:
WABC = WAB + WBC = (B + b).h/2 + b.h = (30 + 10).1/2 + (3 - 1).30 = 40/2 + 2.30 = 20 + 60 = 80 J.
32. No processo isobárico indicado no gráfico, um gás perfeito recebeu 2 000 J de energia do ambiente.
Que variação ocorreu na energia interna desse gás?
I. W = b.h = (60 - 20).30 = 40.30 = 1200 J.
II.ΔU = Q – W = 2000 - 1200 = 800 J.
Qual o trabalho mecânico realizado
pelo gás durante a expansão de A
até C? Dê a resposta em joules.WABC = WAB + WBC = (B + b).h/2 + b.h = (30 + 10).1/2 + (3 - 1).30 = 40/2 + 2.30 = 20 + 60 = 80 J.
32. No processo isobárico indicado no gráfico, um gás perfeito recebeu 2 000 J de energia do ambiente.
Que variação ocorreu na energia interna desse gás?
I. W = b.h = (60 - 20).30 = 40.30 = 1200 J.
II.ΔU = Q – W = 2000 - 1200 = 800 J.














Muito Bom! põe questões de mecânica do fluídos!!
ResponderExcluirO fluxo de calor através de um bloco de madeira de espessura 5cm cujas
ResponderExcluirtemperaturas interna e externa são 40°C e 20°C, respectivamente, foi determinado
com o valor de 40W/m2
. Determine a condutividade térmica damadeira. responde essa ai com a conta
determine a massa de um gás sofre transformação indicadas no diagrama da pressão em funçao do volume determine estado B e C
ResponderExcluirmine as temperaturas responda ai por
A 15 ta incorreta ein
ResponderExcluirNem está, trabalho SOBRE o gás é negativo, -(-) = +
ExcluirMassa mano! Ótimo me ajudaram muito!
ResponderExcluir